Кафедра неврологии педиатрического факультета ГОУ ВПО РГМУ Росздрава
Отделение психоневрологии и эпилепсии (ПНО-2) Российской детской клинической больницы, Москва
А.А. Холин, Е.С. Ильина, Л.М. Колпакчи, И.Д. Федонюк, С.В. Михайлова, Л.И. Семыкина, К.Ю. Мухин, А.С. Петрухин
Злокачественные мигрирующие парциальные приступы младенчества являются редким эпилептическим синдромом с дебютом в возрасте до 6 месяцев жизни, который характеризуется множественными продолжительными электроэнцефалографическими и электроклиническими фокальными приступными паттернами с вовлечением различных независимых отделов обеих гемисфер, а также задержкой психомоторного развития. Представлено подробное описание 6 новых клинических случаев данной формы эпилепсии, впервые выявленных в России. У всех пациентов посредством видео-ЭЭГ мониторирования зафиксировано не менее 3 иктальных паттернов, исходящих из различных отделов обоих гемисфер. Отмечалась высокая частота и выраженный полиморфизм приступов (не менее 5 разновидностей у каждого ребенка). Отмечено частое возникновение эпилептического статуса мигрирующих фокальных приступов (83,3% случаев). При нейровизуализации от- мечена умеренная корковая атрофии у 2 пациентов (33,3%) и грубая корково-подкорковая атрофия у 4 пациентов (66,7%). Пациенты продемонстрировали фармакорезистентность с полным отсутствием реакции на антиэпилептическую терапию и прогрессивным ухудшением у двух пациентов (33,3%). Снижение частоты приступов на 50% отмечалось у 3 пациентов (50%) на фоне комбинации вальпроатов, бензодиазепинов и барбитуратов и на 75% – у одного пациента (16,7%) на фоне комбинации вальпроатов, бензодиазепинов и леветирацетама (кеппры). Авторами предлагается к обсуждению следующее название для данной формы эпилепсии: «Злокачественная эпилепсия младенчества с мигрирующими мультифокальными приступами».
Ключевые слова: злокачественные мигрирующие парциальные приступы младенчества, злокачественная эпилепсия младенчества с мигрирующими мультифокальными приступами, мигрирующие фокальные приступы, эпилептический статус.
Злокачественные мигрирующие парциальные приступы младенчества (ЗМППМ) (Malignant migrating partial seizures in infancy - MMPSI ) – редкий, но часто остающийся нераспознанным эпилептический синдром младенческого возраста. Синдром дебютирует в возрасте до 6 месяцев жизни и характеризуется множественными продолжительными электроэнцефалографическими и электроклиническими фокальными приступными паттернами с вовлечением различных независимых отделов обеих гемисфер, а также задержкой психомоторного развития. Специфических этиологических факторов не выявлено [4].
Эта тяжелая форма эпилепсии описана сравнительно недавно. Первые три клинических описания случаев данного заболевания были представлены G. Coppola et al. (1995); Gerard et al. (1999); Okuda et al. (2000) [2, 5, 7]. E. Veneselli et al. (2001) обобщил предшествующие описания случаев и дополнил их собственными тремя клиническими наблюдениями [9]. В своем эпохальном сообщении G. Coppola et al. в 1995 г. на базе нейропедиатрического отделения Университета Рене Декарта (Париж, Франция) описали клиническое наблюдение четырнадцати младенцев обоего пола с ранее не описанным эпилептическим состоянием, характеризовавшимся практически непрерывными мультифокальными приступами. Согласно ставшим классическими наблюдениям, сделанными G. Coppola (1995), первые приступы возникали в среднем возрасте 3 месяцев, без каких-либо факторов риска. За период от 1 до 10 месяцев приступы становились очень частыми. Приступы носили парциальный характер с разными клиническими характеристиками, а на ЭЭГ отмечались многочисленные независимые разряды, перемещающие из одного кортикального региона в другой в ходе последующих приступов. Не смотря на различную топографию, иктальный ЭЭГ паттерн каждого приступа был практически аналогичным и представлял собой ритмическую активность альфа- или тета-диапазона, склонную к распространению и вовлекающую всё большие отделы коры. У пациентов отмечался регресс в психомоторном развитии в сочетании с развитием квадриплегии с выраженной гипотонией аксиальной мускулатуры [2].
В 2002 г. O. Dulac приводит описание собственного (самого большого по числу зафиксированных случаев) наблюдения 20 пациентов в госпитале Святого Винсента де Паула (Saint Vincent de Paul hospital) [4]. E. Marsh (2005) et al. сообщают еще о шести случаях ЗМППМ, наблюдаемых в Филадельфийском Детском Госпитале и Медицинской Школе Университета Пенсильвании, удовлетворявших критериям диагностики, описанным G. Coppola [2, 6]. Данные описания клинических случаев продемонстровали для эпилептологов всего мира особое эпилептическое состояние, отличное от ранее описанных форм эпилептических энцефалопатий и представляющее собой новый эпилептический синдром. Целью данного исследования явилось изучение клинико -электроэнцефалографической картины у пациентов со злокачественными мигрирующими парциальными приступами младенчества, определение характера приступов и особенностей ЭЭГ паттернов посредством видео-ЭЭГ мониторирования, наблюдение пациентов в динамике и оценка эффективности антиэпилептической терапии.
Материалы и методы. Наше исследование включало всех детей, удовлетворяющих клинико-электроэнцефалографическим критериям синдрома злокачественных мигрирующих парциальных приступов младенчества, проходивших обследование и лечение в отделении психоневрологии и эпилепсии (ПНО-2) РДКБ за период с апреля 2005 г. по сентябрь 2006 г. В исследование включены 6 пациентов (3 девочки и 3 мальчика). Возраст пациентов варьировал от 3 мес до 1 года 1 мес (средний возраст – 8,8 мес) на период последнего наблюдения. Период наблюдения составил от 1 мес до 6 мес (в среднем – 3,5 мес). Всем пациентам в отделении психоневрологии и эпилепсии (ПНО-2) РДКБ был проведен видео-ЭЭГ мониторинг в состоянии бодрствования и во время дневного сна длительностью от 2 до 5 часов, а также мониторирование ЭЭГ в динамике (от 1 до 7 раз). Исследования были проведены посредс- твом прибора портативного видео-ЭЭГ мониторинга «ЭНЦЕФАЛАН-ВИДЕО» на базе мобильного регистратора ЭЭГ РМ-ЭЭГ-19/26 «ЭНЦЕФАЛАН-РМ» (НПКФ «Медиком МТД», г. Таганрог). Исследование имеет проспективный характер, и динамическое наблюдение за данной группой детей продолжается. Результаты исследования. Возраст дебют приступов варьировал от первых суток постнатальной жизни до 6 месяцев (у 3-х пациентов судороги отмечались с первых суток постнатальной жизни, у одного – на 3-и сутки, и в возрасте 3 и 6 месяцев у двух оставшихся пациентов). При этом у 2 пациентов вслед за неонатальными судорогами в 1-е и 3-и сутки жизни отмечался период «ремиссии» с реактивацией клинических приступов в возрасте 5 и 7 мес. Частота приступов варьировала от 30 в сутки до множественных, не поддающихся исчислению миоклонических и малых моторных приступов, а также статусного течения фокальных приступов мигрирующего характера. Эпилептический статус фокальных приступов отмечался у 5 из 6 пациентов (83,3%). Клинические проявления характеризовались выраженным полиморфизмом приступов, у всех пациентов отмечалось 5 и более типов эпилептических приступов. Представленность различных типов приступов:
Характеристика эпилептических приступов у 6 пациентов с мигрирующими парциальными приступами младенчества:
| Виды приступов | Пациенты | n % |
| Эпилептические спазмы | 5 | 83.3% |
| Миоклонические приступы | 3 | 50% |
| Эпилептический миоклонус век | 2 | 33,3% |
| Генерализованные тонические | 3 | 50% |
| Тонические приступы с альтернацией | 6 | 100% |
| Версивные приступы | 6 | 100% |
| Фаринго-оральные приступы | 3 | 50% |
| Гемиклонические | 5 | 83.3% |
| Джексоновский тип | 1 | 16,7% |
| Диалептические | 3 | 50% |
| Приступы апноэ | 3 | 50% |
| Аутомоторные приступы | 2 | 33,3% |
| Ингибиторные | 2 | 33,3% |
| Сенсорные галлюцинаторные (?) | 1 | 16,7% |
| Вторично-генерализованные приступы | 2 | 33,3% |
| Эпилептический статус фокальных моторных приступов | 5 | 83,3% |
В неврологическом статусе обращает внимание, что у половины пациентов отмечалась микроцефалия. У трех пациентов (50%) отмечена бульбарная симптоматика (угнетение глоточных и небных рефлексов). Нарушение иннервации глазодвигательных и мимических мышц выявлено у 4 детей (66,7%). Нарушение мышечного тонуса отмечается у всех пациентов (у 5 детей (83,3%) – в виде диффузной гипотонии, у одного (16,7%) – повышение по спастическому типу с элементами пластики). Грубая задержка психомоторного развития отмечается у всех 6 пациентов.
У всех пациентов посредством одного или нескольких видео-ЭЭГ мониторирований было зафиксировано три и более иктальных ЭЭГ паттерна, исходящих из разных гемисфер, что также являлось критерием включения в данную группу. Морфология иктальных ЭЭГ паттернов была представлена низкоамплитудной быстрой эпилептиформной активностью (так называемый в англоязычной литературе паттерн «low amplitude fast activity» или «lafa»), бета- и альфа-диапазона, регулярной альфа- и «пилообразной» тета-активности у всех пациентов (100%), быстрых регулярных спайк-волновых комплексов (?4 Гц) – у 5 пациентов (83,3%), медленных регулярных пик-волновых комплексов – у 4 пациентов (66,7%), группы полиспайков у 3 пациентов (50%), а также регулярной дельта-активностью с включением отдельных остро-медленноволновых комплексов – у одной пациентки (16,7%). Последовательное развитие иктальных ЭЭГ паттернов при эпилептическом статусе мигрирующих фокальных приступов отражено в серии ЭЭГ пациента Г.Е. (рис. 1–7)
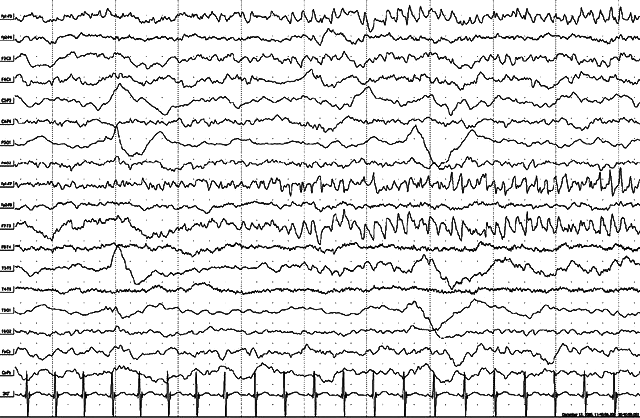
Больной Г.Е., 1 год. Злокачественные мигрирующие парциальные приступы младенчества. Запись ЭЭГ по ходу статусного течения приступов. Появление регионального иктального ЭЭГ паттерна в левой лобной области в виде быстрой эпилептиформной активности с переходом в регулярную активность тета-диапазона с нарастанием амплитуды и включением острых волн. В левой теменно-задневисочной области – дельта-акцентуации после предшествующего приступа. В клинике – правосторонний тонический приступ с орофациальным и адверсивным компонентом.

Тот же больной, 1 год. Продолжение иктальной записи. Иктальная эпилептиформная активность вовлекает соседние области и одноименные отделы правого полушария, но с сохранением левосторонней латерализации. В клинике – билатеральный тонический приступ.
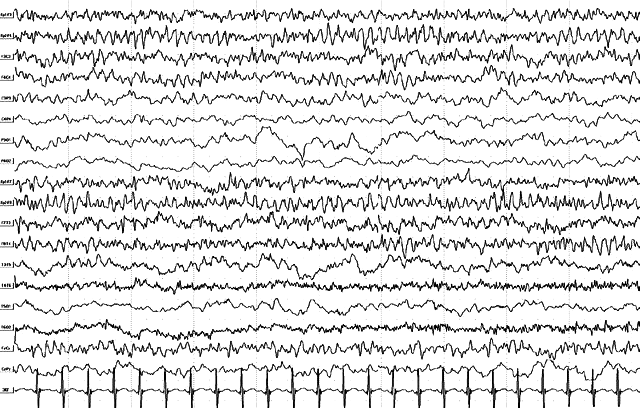
Тот же больной, 1 год. Продолжение иктальной записи. Иктальная эпилептиформная активность в лобных отделах меняет латерализацию на правостороннюю. В клинике – трансформация в асимметричный тонический приступ с левосторонним акцентом.
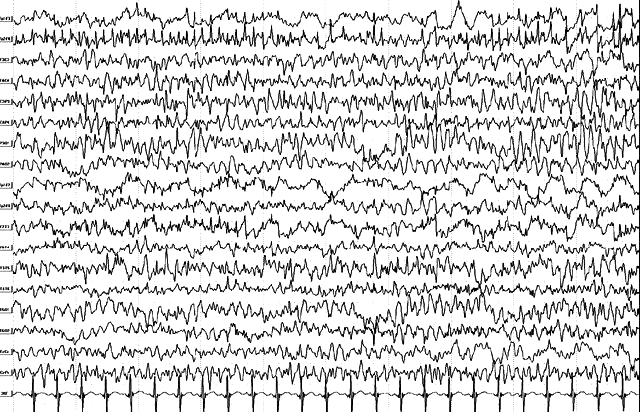
Тот же больной, 1 год. Продолжение иктальной записи. Диффузное распространение иктальной эпилептиформной активности с включением множественных спайков и практически с явлением вторичной генерализации. На этом фоне – появление региональной акцентуации иктального паттерна в левой теменно-задневисочной области. В клинике – трансформация в генерализованный тонический приступ с клоническим компонентом.
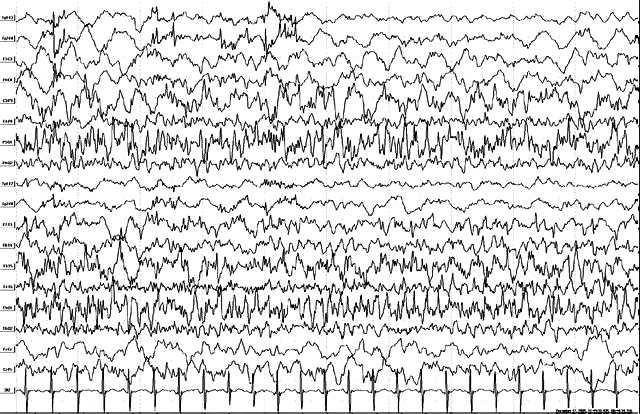
Тот же больной, 1 год. Продолжение иктальной записи. Диффузное замедление частотных характеристик диффузного иктального паттерна с переходом в дельта-замедление. При этом в левой теменно-задневисочной области напротив – активация регионального иктального паттерна с наличием регионально-акцентуированных полиспайков и спайк-волновых комплексов. В клинике – трансформация в асимметричный тонический приступ с правосторонним клоническим компонентом.
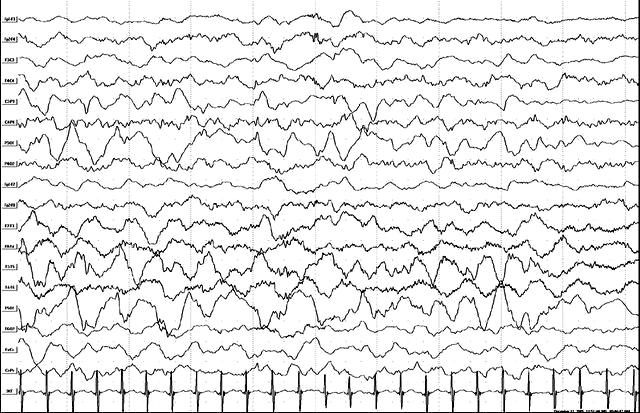
Тот же больной, 1 год. Продолжение иктальной записи. Переход иктального паттерна в левой теменно-задне-височной области в дельта-замедление с включением медленных эпилептиформных комплексов. В тоже время в правом полушарии отмечается появление нового иктального паттерна в виде быстрой низкоамплитудной активности. В клинике – кратковременное стихание клинической выраженности иктальных явлений.
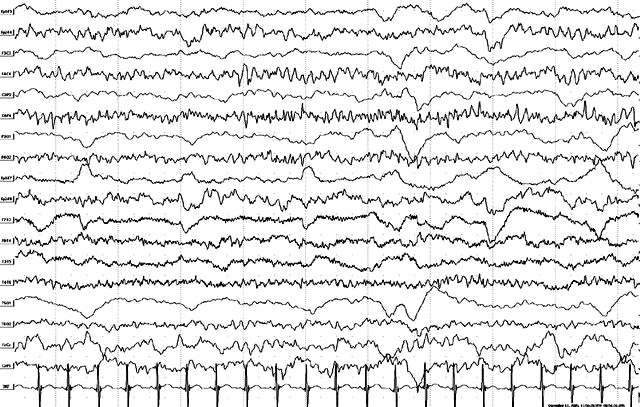
Тот же больной, 1 год. Продолжение иктальной записи. Иктальные явления в правом полушарии в виде регулярной альфа-тета-активности фронто-центральной акцентуации. Постприступные изменения в левом полушарии в виде депрессии биоэлектрической активности с доминированием дельта-форм. В клинике – асимметричный тонический приступ левосторонней акцентуации.
При нейровизуализации отмечаются исключительно атрофические изменения головного мозга разной степени интенсивности, которые варьируют от умеренной корковой субатрофии (2 пациента – 33,3%) до грубой корково-подкорковой атрофии (4 пациента – 66,7%) с выраженным снижением мозгового субстрата у двух из них. Однако ни в одном случае не было обнаружено явных дизонтогенетических нарушений (фокальных кортикальных дисплазий и т.д.). Пациенты продемонстрировали фармакорезистентность с полным отсутствием реакции на антиэпилептическую терапию в различных комбинациях и прогрессивным ухудшением у двух пациентов (33,3%). Снижение приступов на 50% отмечалось у 3 пациентов (50%) и более чем на 75% — только у одного пациента (16,7%).
Обсуждение результатов. По данным нашего исследования оба пола в равной степени подвержены данному заболеванию, что согласуется с мировыми наблюдениями. Так, O. Dulac описал 20 детей с ЗМППМ, из них 9 девочек и 11 мальчиков [4]. Дебют приступов у большинства наших пациентов (4 пациента – 66,7%) отмечался на 1-й неделе постнатальной жизни (у 3-х пациентов судороги возникали с первых суток постнатальной жизни, у одного – на 3-и сутки). У двоих оставшихся пациентов приступы дебютировали в возрасте 3 и 6 месяцев. Показатели также практически согласуются с мировыми данными. Так, согласно G. Coppola et al. (1995) данное заболевание дебютирует в возрастном интервале от 1-й недели до 7 месяцев жизни, в среднем в 3 месяца [2]. Согласно O. Dulac (2002), данная форма эпилепсии дебютирует в возрасте до 6 месяцев жизни [4]. По данным Marsh E. et al. (2005) дебют приступов варьировал в диапазоне от 1-х суток до 3 месяцев (в среднем — 25 дней) [6]. При этом у 2 наших пациентов вслед за неонатальными судорогами в 1-е и 3-и сутки жизни отмечался период «ремиссии» с реактивацией клинических приступов в возрасте 5 и 7 месяцев. Подобный феномен отмечал O. Dulac, выделивший в развитии заболевания начальный период, который может варьировать от 1 недели до 3 месяцев, в среднем в течение 45 дней [3, 4]. При этом отмечаются эпохи «мнимой» ремиссии.
В начале заболевания приступы могут отмечаться только раз в неделю и нередко остаются незамеченными [4]. O. Dulac также отмечает, что течение заболевание и степень выраженности клинических симптомов нередко имеет волнообразный характер: период тяжелого течения может длиться несколько недель и сменяется относительно благоприятным периодом с частичным восстановлением функций, когда приступы становятся редкими и менее тяжелыми, и так до следующего ухудшения. Это явление создает дополнительные трудности в контроле качества лечения, так как довольно тяжело дифференцировать, является ли урежение и снижение тяжести приступов истинной реакцией на лечение, либо оно служит отражением собственного течения заболевания [4]. Подобный эффект наблюдался у половины наших пациентов, что создавало трудности в адекватной оценке качества антиэпилептической терапии. G. Coppola также сообщает о возможности чередования приступных и бесприступных периодов. При этом приступы развиваются в течение 2-5 дней в неделю с наличием «светлых» дней, либо возникают каждый день практически постоянно [2]. Выраженный клинический полиморфизм эпилептических приступов при фокальных младенческих эпилепсиях является известным и давно подмеченным фактом [1-6, 9]. В высшей степени данный полиморфизм характеризует такую тяжелую форму эпилепсии, как злокачественные мигрирующие парциальные приступы младенчества [2, 4, 6, 9].
Клиническая манифестация приступов может характеризоваться адверсией головы и глаз в сторону, латерализованными подергиваниями глазных яблок, фиксацией взора, клоническими подергиваниями век, тоническим напряжением или клониями в одной или двух конечностей с одной из сторон, жевательными движениями, явлениями апноэ, покраснением лица, гиперсаливацией, сосанием и вторично-генерализованными приступами [2]. Множество возможных комбинаций дает широкий диапазон иктальных черт. Наблюдения показывают альтернативное вовлечение корковых отделов обоих полушарий, что подразумевает под собой диффузное вовлечение в эпилептогенез коры больших полушарий. В большинстве случаев приступы слабо выражены и часто протекают незаметно для родителей и медицинского персонала (в частности, такие как кратковременные задержки дыхания, эпизоды закрывания глаз либо отведения глаз в сторону, эпизоды покраснения лица). Лишь видео-ЭЭГ мониторинг позволяет убедительно судить о представленности иктальных феноменов.
Обычно длительность приступа составляет 1-4 минуты, но в ряде случаев приступ может продолжаться до нескольких десятков минут вплоть до развития эпилептического статуса [2, 4]. Так, эпилептический статус фокальных приступов отмечался у 5 (83,3%) наших пациентов. Однако, в исследовании O. Dulac эпилептический статус отмечался существенно реже (в 2 из 14 случаев – 14,3%) [4]. Наличие серийных эпилептических спазмов при данной форме эпилепсии также было отмечено G. Coppola [2]. В нашей группе этот тип приступов был одним из наиболее частых и обнаруживался у 5 (83,3%) наших пациентов. По мере течения заболевания часто возникают вторично-генерализованные приступы [2], отмеченные также у двух наших пациентов (33,3%). E. Marsh et al. (2005) обращали внимание на задержку темпов нарастания окружности головы, выявляемую с возрастом у всех пациентов; в дальнейшем отмечалось развитие тяжелого тетрапареза с выраженной аксиальной гипотонией [6]. Микроцефалия была выявлена нами у половины пациентов, а диффузная мышечная гипотония зарегистрирована у 5 детей (83,3%).
На ЭЭГ при злокачественной мигрирующей парциальной эпилепсии младенчества по данным мировой литературы типичным является диффузное замедление основной активности фона, выявляемое у пациентов с первых записей ЭЭГ. Во всех случаях отмечаются мультифокальные спайки без четкой активации во сне, хотя на начальных этапах развития заболевания эпилептиформная активность на ЭЭГ может не проявляться. Постоянный интериктальный ЭЭГ паттерн не выявлен. Когда приступы становятся очень частыми, интериктальная активность практически не определяется [2, 4, 6].
Наши данные согласуются с вышеизложенными данными литературы. Приступные электроэнцефалографические паттерны возникают и вовлекают разные области коры больших полушарий в ходе последовательно развивающихся приступов. Иктальный паттерн представляет собой ритмическую активность альфа- и тета-диапазона, с возникновением в одном из регионов и прогрессирующим вовлечением соседних областей, с постепенным снижением частотных характеристик иктальной активности [2]. Данный тип иктальных ЭЭГ паттернов обнаруживался у всех из 6 наших пациентов. При этом, у 5 наблюдаемых нами пациентов (83,3%) отмечается трансформация в быстрые регулярные пик-волновые комплексы (?4 Гц), а у 4 пациентов (66,7%) – замедление регулярных пик-волновых комплексов до 2,5-2 Гц. Когда приступы становятся очень частыми, отмечается шифт зоны инициального иктального паттерна из одного региона в другой, а также из одного полушария к другому. Последовательно возникающие приступы могут перекрывать друг друга, в случаях, когда еще не завершился иктальный паттерн в одной области, но уже возник иктальный паттерн, исходящий из другого коркового отдела. В результате возникает продолженная, но мигрирующая иктальная активность, формирующая сложно- составной паттерн эпилептического статуса [2, 6]. На ЭЭГ может отмечается сложная картина, сочетающая на одной эпохе постприступные изменения в одном регионе головного мозга, инициальный иктальный паттерн в другой области и развернутый иктальный паттерн в третьей. В целом, иктальный паттерн демонстрирует миграцию иктальных характеристик от одной области к другой, при этом без формирования устойчивых межрегиональных связей. Вероятно, исключительно за счет миграции иктального паттерна, ребенок способен длительно пребывать в состоянии эпилептического статуса фокальных приступов без развития создающего угрозу для жизни локального отека головного мозга.
Важную роль в диагностике играет видео-ЭЭГ мониторинг, который способен выявить четкую корреляцию между локализацией иктального паттерна и клиническими характеристиками приступа. Так иктальный паттерн в лобной области вызывает клинические явления в виде напряжения контралатеральных конечностей, возможны ипсилатеральные автоматизмы, а также может возникнуть картина адверсивного приступа с формированием позы по типу «фехтовальщика». Перироландический паттерн проявляется контралатеральным клонусом губ и мимической мускулатуры, фаринго-оральными автоматизмами и гиперсаливацией. Височные паттерны проявляются жевательными движениями, широким взглядом по типу «таращенья» (феномен «staring»), альтернирующими тоническими феноменами. Затылочные иктальные паттерны сочетались с латерализованными клониями глазных яблок и девиацией головы. В случаях теменной локализации паттерна возможны изолированные фиксации позы ребенка и неспецифическая двигательная активность, иногда создается впечатление, что ребенок как бы «прислушивается» к своим внутренним ощущениям.
Вышеуказанные явления контрастируют со сложившимся мнением об отсутствии четкой клинико- электроэнцефалографической корреляции фокальных иктальных паттернов у детей очень раннего возраста, и свидетельствует скорее об обратном. Также не таким уж и раритетом представляется наличие у младенцев джексоновских моторных приступов. По мере взросления ребенка амплитуда иктальной активности имеет тенденцию к нарастанию, многие приступы трансформируются во вторично-генерализованные, все больше и больше вовлекаются лобные отделы полушарий. Феномен вторичной билатеральной синхронизации обычно возникает спустя первые недели от начала заболевания [2]. Тем не менее, возможно, в результате более высокой эффективности новых антиэпилептических препаратов и их комбинаций, в ходе последних наблюдений начала развития заболевания у подобных пациентов, отмечается задержка формирования билатеральной синхронизации и дополнительных фокусов эпилептиформной активности до 2 месяцев от начала заболевания [5].
На данном этапе при обнаружении ранней фармакорезистентности может возникнуть ошибочное решение о применении хирургической тактики лечения. При этом немаловажное значение для данной категории пациентов имеет продолженное видео-ЭЭГ мониторирование, так как обнаружение одного или нескольких приступов, исходящих из одной области, еще не означает, что все приступы у данного ребенка исходят только из этой области. Так, больной Ю.А. во время рутинной записи ЭЭГ продемонстрировал множественные независимые спайковые и спайк-волновые разряды, периодически с формированием картины модифицированной гипсаритмии. При этом чаще доминировал региональный акцент в левой височной области. В ходе рутинного (длительностью 15 минут) исследования был зафиксирован асимметричный фокальный тонический приступ, исходящий из левой височной доли. Данные явления позволили предположить предварительный диагноз симптоматической фокальной височной эпилепсии с мимикрией синдрома Веста. Можно было предположить главную роль левостороннего височного очага как в генезе всех приступов у ребенка, так и в формировании «вторичных» эпилептогенных зон. В совокупности с данными нейровизуализации, показавшими преобладание атрофических изменений именно в этой доле (левой височной), а также с учетом ранней резистентности и катастрофического течения заболевания, данный ребенок мог бы рассматриваться в качестве кандидата для хирургического лечения эпилепсии в как можно более ранние сроки. Тем не менее, первичное обследование было пролонгировано до 1 часа. При просмотре записи были обнаружены приступы, исходящие из других областей и имеющие отличную кинематику. Ребенку был выставлен диагноз — тяжелая эпилепсия с множественными независимыми фокусами спайков (синдром Марканда-Блюма-Отахара). Однако в ходе последующих динамических обследований по мере прогрессирования заболевания был зафиксирован факт миграции иктального паттерна в ходе фокальных приступов. Иктальные паттерны трансформировались один в другой и мигрировали в пределах как одной гемисферы, а также переходили на другую. Несмотря на агрессивную антиэпилептическую терапию, состояние ребенка прогрессивно ухудшалось. Практически отмечался статус мигрирующих фокальных приступов. Таким образом, данный тип течения заболевания был характерен для злокачественной мигрирующей парциальной эпилепсии младенчества.
Данные нейровизуализации у нашей группы пациентов контрастируют с данными мировой литературы, согласно которым изменения на компьютерной томографии и магнитно-резонансной визуализации не характерны, и большинство случаев расцениваются, как криптогенные [2, 4, 5, 6]. У наших больных только в 2 случаях (33,3%) отмечалась умеренная корковая субатрофия, и данные случаи могли трактоваться как криптогенные. В то же время у 4 пациентов (66,7%) отмечалась грубая корково-подкорковая атрофия, при этом в 2-х случаях с выраженным уменьшением мозгового субстрата (33,3%). Однако ни в одном случае не было обнаружено явных дизонтогенетических нарушений, и патологические находки имели гипоксически-ишемический генез. Согласно описанным в мировой литературе клиническим случаям, данная форма эпилепсии резистентна к терапии и характеризуется серьезным прогнозом. Традиционные и новые антиэпилептические препараты в различных комбинациях, а также стероидные гормоны оказываются неэффективными. По мере развития заболевания в течение нескольких месяцев отмечается нарастание частоты и длительности приступов, вплоть до кластерного статусного характера. Ряд пациентов умирает на первом году жизни, либо на первой декаде жизни на фоне множественных продолжительных эпилептических приступов, развития респираторного дистресс-синдрома и декортикационной ригидности [4]. Смертность при данном синдроме, на основании обобщенных клинических наблюдений, составляет 28% [6]. Однако, по описанию J. Perez и соавт. (1999), в двух случаях была отмечена ремиссия приступов на фоне комбинации стрипентола и высоких доз клоназепама [8]. K. Okuda и соавт. (2000 г) сообщают об эффективности применения бромистого калия при мигрирующих парциальных приступах младенчества. Так у мальчика в возрасте 3 мес и девочки в возрасте 4 мес на фоне неэффективности основных антиэпилептических препаратов терапия бромистым калием в дозе 80 мг/кг в сутки привела к полной ремиссии приступов в одном случае и значительному урежению (на 95%) приступов в другом случае [7]. При применении обеих описанных схем лечения, в случае контроля над приступами отмечается постепенное улучшение психомоторного развития, что еще раз доказывает ведущую роль эпилептиформной активности и персистирующих приступов в формировании энцефалопатии и задержки развития [4].
По данным L.L. Francois et al. (2003), мигрирующая парциальная эпилепсия младенчества также всегда резистентна к кетогенной диете. Хирургическое лечение данной формы эпилепсии представляется нецелесообразным [4]. Наши пациенты продемонстрировали фармакорезистентность с полным отсутствием реакции на антиэпилептическую терапию в различных комбинациях и прогрессивным ухудшением у двух пациентов (33,3%). При этом вызывает интерес и удивление, что именно эти два случая изначально характеризовались умеренными неспецифическими изменениями при нейровизуализации. Ни в одном из 6 случаев не было достигнуто полной клинической ремиссии. Эпилептические приступы сохраняют склонность к статусному течению у двух пациентов. Эти дети часто требуют реанимационных мероприятий, как из-за статусного характера приступов, так и учитывая сочетанную неврологическую патологию, включая бульбарный и псевдобульбарный синдромы, аспирационные пневмонии, сердечно-легочную недостаточность. Гормональная терапия и терапия высокими дозами витамина В6 не оказывала существенного эффекта или эффект был временный. Как правило, умеренный положительный эффект отмечался на фоне комбинированной терапии с использованием барбитуратов и бензодиазепинов. Снижение приступов на 50% отмечалось у 3 пациентов (50%) на фоне следующих комбинаций: конвулекс + гексамидин + фризиум, конвулекс + фризиум, депакин + гексамидин. Снижение приступов более чем на 75% отмечалось только у одного пациента (16,7%) на фоне комбинации конвулекса, клоназепама и кеппры.
Заключение. Злокачественные мигрирующие парциальные приступы младенчества являются самостоятельным эпилептическим синдромом с особенными, отличными от остальных форм эпилепсии клинико-нейрофи-зиологическими характеристиками. Диагноз может быть установлен при наличии различных типов фокальных приступов, сопровождающихся множественными продолжительными электроэнцефалографическими и электроклиническими приступными паттернами с вовлечением множественных независимых отделов обеих гемисфер. Форма является возраст-зависимой и дебютирует до 6 месячного возраста (часто на 1-й неделе жизни). Согласно мнению O. Dulac (2002), злокачественные мигрирующие парциальные приступы младенчества являются третьим типом младенческой эпилептической энцефалопатии (наряду с ранними энцефалопатиями с супрессивно-взрыв- ным паттерном и синдромом Веста), при котором кора головного мозга более склонна к генерации эпилептического возбуждения, мигрирующего от одной области коры к другой, без четкой межрегиональной организации. Данное состояние обусловлено возрастными особенностями младенческого мозга с гипервозбудимость коры на определенном эволюционном этапе [4]. Учитывая, что термин «злокачественные мигрирующие парциальные приступы младенчества» характеризует данную форму эпилепсии скорее как симптомокомплекс, мы предлагаем к обсуждению следующее название: «злокачественная эпилепсия младенчества с мигрирующими мультифокальными приступами», возможно более полно отражающее суть заболевания.
Библиография:
1. Chiron C., Soufflet C., Pollack C., Cusmai R. Semiology of cryptogenic multifocal partial seizures in infancy //Electroencephalogr Clin Neurophysiol. — 1988. — V. 70. — P. 9-16.
2. Coppola G., Plouin P., Chiron C., Robain O., Dulac O. Migrating partial seizures in infancy: a malignant disorder with developmental arrest // Epilepsia. — 1995. — V. 36(10). — P. 1017-24.
3. Dulac O., Chiron C. Malignant epileptic encephalopathies in children // Baillieres Clin Neurol. — 1996. — V. 5(4). – P. 765-81.
4. Dulac O. Malignant migrating partial seizures in infancy // In: Epileptic Syndromes in Infancy, Childhood and Adolescence (3rd edn) / J. Roger, M. Bureau, Ch. Dravet, P. Genton, C.A. Tassinati; P. Wolf — John Libbey & Co Ltd, 2002. — P. 65-68.
5. Gerard F., Kaminska A., Plouin P., Echenne B., Dulac O. Focal seizures versus focal epilepsy in infancy: a challenging distinction // EpilDisord. — 1999. — V. 1. — P. 135-139.
6. Marsh E., Melamed S.E., Barron T., Clancy R.R. Migrating partial seizures in infancy: expanding the phenotype of a rare seizure syndrome // Epilepsia. — 2005. — V. 46(4). — P. 568-72.
7. Okuda K., Yasuhara A., Kamei A., Araki A., Kitamura N., Kobayashi Y. Successful control with bromide of two patients with malignant migrating partial seizures in infancy // Brain Dev. — 2000. — V.22(1). — P. 56-9.
8. Perez J., Chiron C., Musial C., Rey E., Blehaut H., d’Athis, Vincent J., Dulac O. Stiripentol: efficacy and tolerability in epileptic children // Epilepsia. — 1999. — V. 40. — P. 1618-1626.
9. Veneselli E., Perrone M.V., Di Rocco M., Gaggero R., Biancheri R. Malignant migrating partial seizures in infancy //Epilepsy Res. — 2001. — V.46(1). — P. 27-32.
|
Написать письмо в офис фирмы. Ваши комментарии вебмастеру сайта. |
© 1997-2014 Медиком-МТД Все права защищены. |